Warum versagen an Tieren getestete Medikamente in klinischen Tests?

Klinische Studien garantieren, dass menschliche und tierische Patienten möglichst sichere Medikamente erhalten. Kein Medikament kann 100% sicher sein, also gar keine Nebenwirkungen haben. Die Tests an Tier und Mensch sind deshalb so streng, damit Medikamente entwickelt werden, die möglichst wirksam und mit möglichst wenig Nebenwirkungen verbunden sind.
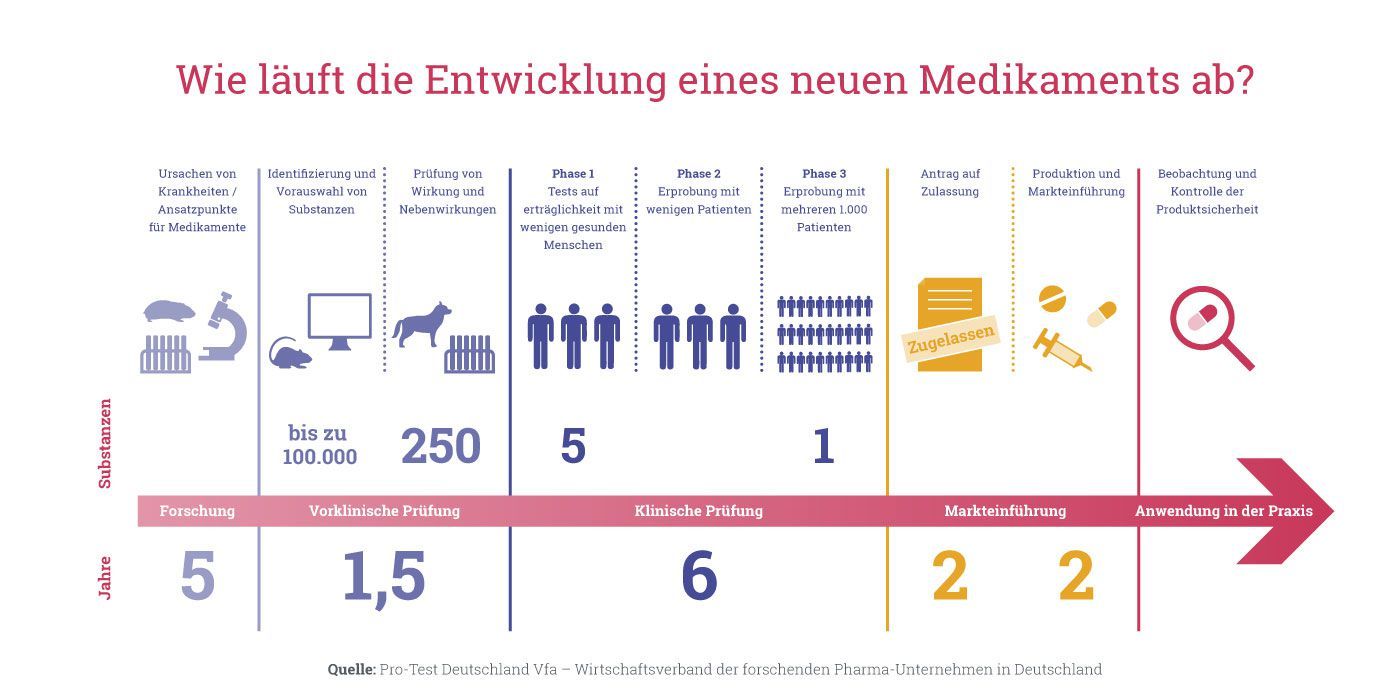
Dazu muss man verstehen, wie diese Medikamentenprüfungen ablaufen: Damit ein neuer Wirkstoff als Medikament zugelassen und auf den Markt gebracht werden kann, muss er verschiedene Testphasen durchlaufen. Zunächst werden nur Untersuchungen an Zellkulturen und an Versuchstieren durchgeführt. Sind sie erfolgreich, werden sie zunächst an nur wenigen Menschen und – wenn der Nutzen als gross und das Risiko als gering erachtet wird – schrittweise an immer mehr Menschen erprobt.
In den präklinischen Sicherheitstest (d.h. in Studien am Tier) fällt bereits etwa ein Drittel der experimentellen Medikamente durch, da sie sich als nicht wirksam oder zu gefährlich erweisen. Viele Substanzen scheitern dann noch in den späteren Phasen der klinischen Studien aus unterschiedlichen Gründen. Dass ein Präparat nicht auf den Markt kommt, liegt also oft daran, dass es in Untersuchungen an Zellkulturen oder in Tierversuchen als zu gefährlich für den Menschen eingestuft wird. Dies bedeutet das Aus für die Weiterentwicklung eines Präparats.
Hier sind diese behördlich vorgegebenen Phasen im Detail beschrieben; die Weiterentwicklung eines Medikaments hängt dabei vom erfolgreichen Abschluss jeder Phase ab:
Präklinische Phase
An Zell- oder Gewebekulturen wird untersucht, wie eine Substanz wirkt. Wenn es verlässliche Hinweise gibt, dass sie theoretisch in einem Organismus wirksam ist, werden Tierversuche durchgeführt. Man beginnt zunächst mit kleinen Studien mit sehr wenigen Tieren. Die Fragen, die dort beantwortet werden, sind: «Gibt es einen möglichen therapeutischen Nutzen?», «Ist das Präparat sicher genug, um in der Phase I beim Menschen eingesetzt zu werden?». Zudem werden Untersuchungen zur Dosis, Wirkung und Verteilung im Körper (Pharmakologie und Pharmakokinetik) am Tier durchgeführt. In der folgenden vorklinischen Entwicklung geht es dann in weiteren Tierversuchen auch um Verträglichkeitsprüfungen (Toxizitätstests) und um z.B. Missbildungen bei Föten auszuschliessen. Die meisten dieser präklinischen Tierversuchsstudien sind in Bezug auf ihre Grösse und Fragestellung durch regulatorische Vorgaben durch Swissmedic oder die amerikanische Food and Drug Agency FDA vorgegeben. Die Ergebnisse werden von den Zulassungsbehörden geprüft, und klinische Tests im Menschen sind nur mit Genehmigung dieser Behörden zulässig. Eine pharmazeutische Firma muss also Tierversuche durchführen, wenn sie ein Medikament auf den Markt bringen möchte, weil sie sonst nicht die Erlaubnis für klinische Substanztests im Menschen bekäme.
Phase I
Dies ist die erste Untersuchung am Menschen. Diese Phase darf nur gestartet werden, wenn die Ergebnisse in vorgeschalteten Tierversuchen positiv waren und die Substanz als sicher genug gilt, um einen ersten Test im Menschen zu wagen. An nur wenigen Personen wird unter strikten Auflagen und strenger Überwachung getestet, ob ein Wirkstoff einen Behandlungserfolg bringt, respektive ob er auch im Menschen sicher ist. Diese Verträglichkeit wird üblicherweise an sechs bis zehn gesunden Freiwilligen oder an schwerkranken Patientinnen und Patienten untersucht, denen keine weiteren Behandlungsoptionen zur Verfügung stehen. Fragen, die Forscherinnen und Forscher in der Phase I beantworten wollen, sind: «Welche Wirkungen hat der Wirkstoff beim Menschen?», «Welche Nebenwirkungen treten auf?», «Ist ein Medikament sicher genug, um es an einer grösseren Gruppe von Patientinnen und Patienten zu untersuchen?».
Phase II
Wenn in der Phase I genügend Hinweise gefunden wurden, dass ein Medikament einen Nutzen bringt und keine Sicherheitsbedenken aufgetaucht sind, kann der Wirkstoff in der klinischen Phase II weiter untersucht werden. Jetzt wird er an einer kleinen Zahl von ausgewählten Patienten getestet. Je nach Art der Erkrankung, gegen die der Wirkstoff eingesetzt wird, wird eine Phase II-Studie an zwanzig bis dreihundert Probanden durchgeführt. Hier stehen vor allem Fragen im Vordergrund wie: «Wie hängt der Behandlungserfolg von der Dosierung ab?» oder «Was ist das wirksamste Therapieschema?». Auch in dieser Phase gibt es noch parallele Studien am Tier, um die Auswirkung des Medikaments auf die Fortpflanzung zu testen.
Phase III
Wenn die Ergebnisse der Phasen I und II ermutigend sind, beginnt die klinische Phase III, in der ein neues Medikament an einer grossen Patientengruppe unter praxisnahen Bedingungen noch genauer untersucht wird. Hier wird es an dreihundert bis dreitausend oder sogar noch mehr Probanden geprüft. In der Phase III geht es vor allem darum, zu klären: «Ist die Sicherheit und Wirksamkeit des neuen Prüfpräparats besser, schlechter oder gleich wie vergleichbare etablierte Behandlungen?», «Wie verhält sich der untersuchte Wirkstoff in Kombination mit anderen Arzneimitteln?» oder «Wie kann das Medikament Patienten am besten verordnet werden?».
Auch in Phase III laufen parallel noch Tierversuche, um eine krebserzeugende Wirkung nach Langzeitanwendung möglichst auszuschliessen.
Phase IV
Nach dem erfolgreichen Abschluss der Phase III kann das Medikament zugelassen werden, wird aber im Rahmen von Studien der klinischen Phase IV weiter überwacht, indem Nebenwirkungen erfasst und ausgewertet werden. Im medizinischen Alltag nimmt eine sehr grosse Anzahl von Patientinnen und Patienten das Medikament, so dass viele Daten zur Wirksamkeit und zur Langzeitwirkung gewonnen werden. So ist es auch möglich, sehr seltene Nebenwirkungen zu erkennen.